Структура мембранных белковСтраница 2
3. Связывание с помощью гидрофобного "якоря"; эта структура обычно выявляется как последовательность неполярных аминокислотных остатков (например, у цитохрома 65). Некоторые мембранные белки используют в качестве якоря ковалентно связанные с ними жирные кислоты или фосфолипиды.
4. Трансмембранные белки. Одни из них пересекают мембрану только один раз (например, гликофорин), другие - несколько раз (например, лактозопермеаза; бактериородопсин).
Различиями между наружными (или периферическими) и внутренними (или интегральными) мембранными белками не задается однозначно способ их прикрепления к бислою; эти различия определяют лишь относительную силу их связывания.
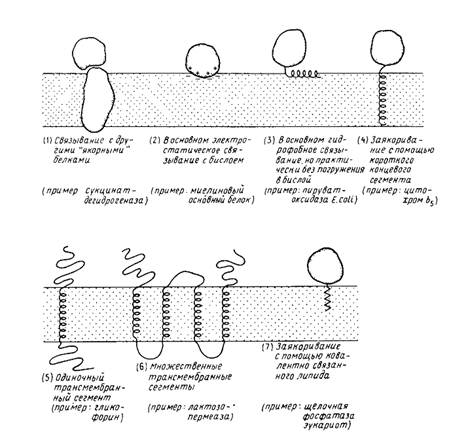
Рис. 1
Различные способы прикрепления мембранных белков к мембране. Пептидный якорь (4) может находиться либо на N-, либо на С-конце молекулы. N – и С-концы трансмембранных белков (5 и 6) могут находиться как у наружной, так и у внутренней поверхности мембраны.
Похожие материалы:
Зависимость процесса фотосинтеза от факторов
внешней среды
При оценке действия внешних факторов необходимо различать два уровня. Первый их них генетический, который определяется влиянием факторов на генетический аппарат и экспрессию генов. Второй уровень обусловлен прямым действием внешних фактор ...
JBL Gyrodol
Лекарство против жаберных и кожных сосальщиков и других червеобразных паразитов
• Борется не только с жабровыми и кожными сосальщиками (Trematoda), но и с ленточными червями (Cestoda)
• Справляется с инфекциями в течение 6 часов!
• Сод ...
Дыхание и горение
Расщепление органических веществ, происходящее в клетке, часто сравнивают с горением: в обоих случаях происходит поглощение кислорода и выделение продуктов окисления — СО2 и Н2О. Однако состав продуктов горения неопределенный и непостоянн ...

