Хлорофиллы: состав, структура, биосинтез, оптические и химические свойства,
значениеСтраница 2
Физико-химические свойства хлорофиллов.
В твердом виде хлорофилл а представляет собой аморфное вещество сине-черного цвета. Температура плавления хлорофилла а 117 — 120 °С. Хлорофиллы хорошо растворимы в этиловом эфире, бензоле, хлороформе, ацетоне, этиловом спирте, плохо растворимы в петролейном эфире и нерастворимы в воде. Раствор хлорофилла а в этиловом эфире имеет сине-зеленый цвет, хлорофилла b — желто-зеленый. Резко выраженные максимумы поглощения хлорофиллов лежат в красной и синей частях спектра.
В этиловом эфире максимумы поглощения хлорофиллов группы а в красной части спектра — в пределах 660 — 663 нм, в синей — 428 — 430 нм, хлорофилла b — соответственно в пределах 642 — 644 и 452 — 455 нм. Хлорофиллы очень слабо поглощают оранжевый и желтый свет и совсем не поглощают зеленые и инфракрасные лучи. Поглощение в сине-фиолетовой части спектра обусловлено системой конъюгированных одинарных и двойных связей порфиринового кольца молекулы хлорофилла. Интенсивная полоса поглощения в красной области связана с гидрированием двойной связи у С7 — С8 в IV пиррольном ядре (при переходе от протохлорофиллида к хлорофиллиду) и присутствием магния в порфириновом кольце. Эти же условия способствуют снижению поглощения в желтой и зеленой частях спектра. Замещение магния протонами при обработке хлорофилла кислотой приводит к образованию феофетина, имеющего буро-зеленый цвет и ослабленный красный максимум поглощения. Удаление остатков фитола и метилового спирта путем щелочного гидролиза мало сказывается на спектре поглощения хлорофилла. У хлорофиллина те же спектральные свойства, что и у хлорофилла: он зеленый, имеет красный и синий максимумы поглощения.
На положение максимумов спектра поглощения оказывают влияние природа растворителя и взаимодействие молекул хлорофилла друг с другом, а также с другими пигментами, липидами и белками. У агрегированных молекул хлорофилла (например, в твердых пленках и у хлорофилла, находящегося в хлоропластах) красный максимум поглощения сдвинут в более длинноволновую область (до 680 нм).
Растворы хлорофиллов в полярных растворителях обладают яркой флуоресценцией (люминесценцией). В этиловом эфире у хлорофилла а наблюдается рубиново-красная флуоресценция с максимумом 668 нм, у хлорофилла b — 648 нм т. е. максимумы флуоресценции в соответствии с правилом Стокса несколько сдвинуты в более длинноволновую часть спектра по отношению к максимумам поглощения. Агрегированный хлорофилл и хлорофилл в нативном состоянии (в живом листе) флуоресцируют слабо. Растворы хлорофиллов способны также к фосфоресценции (т. е. длительному послесвечению), максимум которого лежит в инфракрасной области.
Механизмы флуоресценции и фосфоресценции, в том числе молекул хлорофилла, достаточно хорошо изучены. Наиболее устойчивы те состояния атомов и молекул, в которых валентные электроны занимают самые низкие энергетические уровни и распределены по ним согласно принципу Паули (не более двух электронов с антипараллельными спинами на каждой орбитали). Такое состояние молекулы называют основным синглетным (S0) энергетическим состоянием. Суммарный спин (вектор магнитных моментов) всех электронов молекулы в этом случае равен нулю. Когда молекула поглощает квант света, то за счет этой энергии электрон переходит на более высокие вакантные орбитали. Если у возбужденного электрона сохраняется то же направление спина, то молекула находится в синглетном возбужденном состоянии (S*). Если при переходе на более высокую орбиталь спин электрона обращается, то такое возбуждение называется триплетным (T*). Прямой переход из основного состояния в триплетное — маловероятное событие, так как для этого необходимо обращение ориентации спина. Переходу молекулы из основного состояния в возбужденное, происходящему при поглощении кванта света, соответствует полоса в спектре поглощения.
Поглощение молекулой хлорофилла кванта красного света приводит к синглетному электронвозбужденному состоянию — S*1.
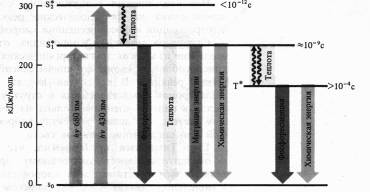
При поглощении кванта синего света с более высоким уровнем энергии электрон переходит на более высокую орбиту (
S
*
2).
Возбужденная молекула хлорофилла возвращается в основное состояние различными путями. Отдав часть энергии в виде теплоты (особенно с уровня S*1), молекула может излучить квант света с большей длиной волны (правило Стокса),
Похожие материалы:
Теория эволюционного происхождения
человека от высокоразвитой ископаемой обезьяны. Книга Ч.Дарвина
"Происхождение человека и половой отбор"
На Земле существуют не менее 2 млн. видов животных, до 0,5 млн. видов растений, сотни тысяч видов грибов и микроорганизмов. Как возникло великое многообразие видов и приспособленность их к среде обитания? Ответ дает научная теория эволюци ...
Биография ученого, внесшего существенный вклад в биологии
Ламарк Жан Батист Пьер Антуан де Моне (01.08.1744-18.12.1829) - Французский естествоиспытатель, создатель первой целостной эволюционной теории (развитие живой природы), член Парижской АН (1783г.).
В 1772-1776г.г. в Высшей медицинской шко ...
Ноосфера – сфера разума
Название ноосфера происходит от греческого «ноос» – разум и обозначает, таким образом, сферу разума. Однако представление о ноосфере в настоящее время не является однозначным. В.И. Вернадский, развивая учение о биосфере, придавал понятию ...

